Los pilares de la estructura molecular I

Los pilares de la estructura molecular II
21 noviembre, 2018
Número de Coordinación
11 octubre, 2023LOS PILARES DE LA ESTRUCTURA MOLECULAR
I – QUÍMICA ORGÁNICA (1790 – 1879)
Arnulfo Poveda P., Departamento de Química
Universidad Nacional de Colombia – Bogotá
RESUMEN. En este ensayo se describe el desarrollo del concepto de estructura molecular en química desde la década de 1790 hasta 1870.
El reto más importante cuando se descubre o se crea un nuevo compuesto consiste en dilucidar su estructura molecular ya que esta característica es la que nos indica que el compuesto es realmente nuevo. La estructura molecular nos permite llegar a conocer las propiedades de un compuesto.
INTRODUCCIÓN
A medida que los químicos avanzaron en el estudio de la materia, surgieron una serie de preguntas que considero de naturaleza fundamental.
Estas preguntas fundamentales y el conocimiento de cuáles son sus respuestas y cómo se llegó a ellas constituyen el punto de partida para el estudio y la comprensión de la Química.
Las preguntas fundamentales que se formularon y que en su orden se respondieron, fueron:
- ¿De qué están hechas las sustancias?
- ¿Qué diferencia una sustancia de otra?
- ¿Por qué se unen los átomos o por qué permanecen unidos?
- ¿Cuántos átomos de un elemento se pueden unir a un átomo de otro elemento?
- ¿Cómo están colocados los átomos unos con respecto a otros y en que dirección?
La respuesta a la pregunta 5 condujo al establecimiento de la estructura molecular. De alguna manera, esta respuesta involucra las cuatro anteriores, en otras palabras, es el compendio de todas las demás.
Puede considerarse que la estructura química se consolidó en tres etapas de acuerdo con su complejidad.
- La estructura de las moléculas sencillas, iónicas o inorgánicas propiamente dichas (1790-1820), aclaradas fundamentalmente por los trabajos de Lavoisier Proust y Berzelius.
- La estructura de las moléculas orgánicas (1828-1870), entre cuyos artífices se cuentan Wöhler, Dumas, Liebig, Gerhardt, Laurent, Frankland, Wurtz, Couper, Butlerov y que fue culminada por Kekule, LeBel y Van’t Hoff.
- La estructura de los “complejos”, propuesta por Werner. Estos compuestos se llamaron inicialmente así porque su estructura y propiedades no podían entenderse fácilmente. Fue necesario esperar hasta 1893 para la explicación de su estructura y hasta 1914 para un mayor detalle de la misma con base en las teorías del enlace y la estructura Química.
DESARROLLO
Cuando J. L. Proust en 1799 definió una sustancia química verdadera como aquella que tiene una composición constante, pareció que por fin era posible diferenciar una sustancia pura de una mezcla o de una solución o, lo más importante, de otra sustancia pura, ya que su composición química debería ser diferente.
En verdad, esta definición es clave aún hoy en día para diferenciar claramente unos compuestos de otros y de los compuestos no puros. Se había dado un gran paso y se daba por sentado que esta definición era siempre correcta. Así que cuando Gay Lussac, editor de la revista Annales de Chimie, recibió en 1824 un artículo de J. Von Liebig dando cuenta del análisis y propiedades del compuesto ácido fulmínico, con la misma composición química del compuesto ácido ciánico, presentado por Wöhler en una [1]comunicación a la misma revista el mismo año, pero con propiedades diferentes, la primera reacción, fue que alguno de los dos artículos estaba equivocado, pues esto no podía ser, ya que si tenían la misma composición debería tratarse de la misma sustancia1.
La cuestión era seria y por tanto fue llevada a Berzelius, el químico más famoso de la época. Además de una experimentación rigurosa, Berzelius esperó hasta obtener evidencia de otras sustancias que presentaran el mismo comportamiento. Finalmente, confirmó en 1832 que se trataba de diferentes sustancias a pesar de tener la misma composición química y dio a este tipo de compuestos el nombre de isómeros, para indicar que teniendo la misma composición eran químicamente diferentes.
¿En qué radicaba entonces esa diferencia? Tenía que ser necesariamente en la diferente manera como los átomos de las sustancias están unidos los unos a los otros. De aquí en adelante quedaba entonces planteada una nueva cuestión en el ambiente, una nueva inquietud, una nueva e importante curiosidad, un campo de trabajo que aún hoy en día es muy activo y es encontrar “cómo están unidos los átomos en las moléculas”. La investigación de esta temática es lo que constituye el estudio de la Química Estructural.
En aquel entonces, la presencia de los isómeros, probablemente se consideró una excepción o rareza, pero lo que si despertó interés fue el querer saber cómo están unidos los átomos en las moléculas.
La cuestión se tornó aún más interesante cuando, durante el desarrollo de la química orgánica, en el debate de las sustituciones – teoría de los núcleos – sustentada especialmente por Laurent, éste aseveró que en las propiedades químicas de una sustancia es más importante el número y la manera como los átomos están enlazados entre sí, que la misma clase de átomos que la forman, cuando escribió “ We shall imitate the botanists, who arrange in the species Rose, the white, the yellow, and the variegate rose, and do not attach any importance to the colors of their petals”. Esa recomendación constituye el origen del concepto de Simetría en Química, herramienta fundamental hoy en día, y de uso común para la comprensión de la química. Es de anotar que de alguna manera Mitscherlich (1821) había hecho una sugerencia similar cuando describió el principio del isomorfismo.
Para entender cómo estaban unidos los átomos en las moléculas, era importante saber primero cuántos átomos podrían estar unidos a otro. Según Dalton (1808), si una sustancia estaba constituida por dos elementos, la molécula debería estar conformada por un átomo de cada elemento, regla de máxima simplicidad; así para la molécula de agua, se planteó la formula que hoy correspondería a OH. Por otra parte, si había varias sustancias que estuvieran compuestas de sólo dos elementos y siendo estos los mismos, la composición de las moléculas sería 1:1, 2:1, 3:1, o 1:2, 1:3, etc., según la “ley de las proporciones múltiples”. Sin embargo, esta teoría no era totalmente aceptada, entre otros motivos, por las discrepancias que existían en la determinación de los pesos atómicos relativos.
En la década de 1840 se desarrolló la teoría de los tipos, así la del tipo del amoníaco, propuesta por Wurtz en 1849 mostraba cómo cada uno de los tres hidrógenos se podía reemplazar por un radical “elemento” y en total solo por tres. Se nota entonces que el nitrógeno en este caso, siempre se une a tres “elementos”. Es en 1852 cuando se afianza el concepto de valencia al conocer el trabajo de Frankland quien, preocupado por demostrar la existencia de los “radicales” como elementos estables, buscaba la manera de aislarlos. Así al intentar aislar el “radical” etilo tratando el yoduro de etilo con zinc, se encontró con dietilzinc – primer organometálico. Y al continuar con sus investigaciones obtuvo una serie de compuestos similares derivados del arsénico, antimonio, y bismuto. Al observar la relación en la cual se combinaban estos elementos con diferentes grupos y estudiando las relaciones de otros compuestos sencillos de los elementos N, P, Sb y As, encontró que éstos siempre se combinaban con otros tres, como por ejemplo en : NO3, NH3 , PO3, PH3, PCl3, SbH3, SbCl3, etc., entonces escribió: “…de los ejemplos dados es suficientemente evidente que prevalece una tendencia o ley y que sin importar cuál puede ser el carácter de los átomos que se unen, la fuerza de combinación del átomo atrayente, si me permiten el término, siempre está satisfecha por el mismo número de estos átomos”. Clave en el desarrollo de la estructura química, fue el grupo de la Sorbona, es decir, el grupo de Wurtz: Couper, Butlerov y Kekule. Los tres tuvieron algún contacto con Wurtz en la Universidad de la Sorbona en 1858 y durante el mismo año, en diferentes ocasiones, los tres se pronunciaron acerca de la estructura química, en conferencias o en artículos, estos últimos son de gran importancia pues constituyen el testimonio escrito de los hallazgos, en orden cronológico.
Este punto es interesante, puesto que cada uno de estos químicos era de nacionalidad diferente, Couper, escocés; Butlerov, ruso y Kekule, alemán, así que cada país intentó darle prioridad a sus nacionales. Lo que se desprende de lo anterior es que el grupo de Wurtz estaba en contacto y que sus discusiones deberían girar alrededor de la estructura de las moléculas.
A Couper se le reconoce el haber sido el primero en utilizar fórmulas gráficas para representar los compuestos orgánicos, en los cuales utilizó trazos punteados primero y luego trazos continuos para indicar la unión entre átomos. Aun cuando estos no se representaban como hoy en día, si proporcionaban alguna información consecuente con los conocimientos de la época, si se tiene en cuenta que la cuestión de los pesos atómicos sólo se aclaró a partir del congreso de Karlsruhe en 1860.
Butlerov expuso su teoría en un encuentro en París el 17 de febrero de 1858; en 1864 publicó su libro “ Introduction to the Study of Organic Chemistry”, traducido al alemán en 1868; en él utilizó las fórmulas gráficas o estructurales y fue el primero en mencionar el término “ESTRUCTURA QUÍMICA”, después de Proust, dio tal vez el paso definitivo cuando enfatizó que para cada fórmula estructural sólo existe un compuesto y que cada compuesto individual sólo se puede representar por una fórmula estructural.
No debe extrañarnos el que Kekule, quien “en realidad” había estudiado arquitectura en Alemania, al unirse al grupo de Wurtz, hubiera tomado el tema de la estructura de las moléculas como un reto, como conocedor que era de los elementos de la arquitectura. Si bien se considera que eran varios los químicos que en 1858 conocían la tertravalencia del carbono, es a Kekule a quien se le atribuye el haberlo expuesto claramente, ya que en su artículo “On the Constitution and Metamorphoses of Chemical Compounds and on the Chemical Nature of Carbon”, publicado en los Liebig’s Annalen en 1858, escribió: “ Si observamos los compuestos más simples de este elemento (C), CH4, CH3Cl, CCl4, CHCl3, COCl2, CO2, CS2, CNH, nos encontramos con el hecho de que la cantidad de carbono que es considerada por los químicos como la menor cantidad posible de existencia – el átomo – , siempre se une a cuatro átomos monoatómicos (de atomicidad= valencia), o dos de un elemento diatómico, de tal manera , que la suma de las unidades químicas de los elementos combinados con un átomo de carbono, siempre es igual a cuatro.
En el mismo artículo, Kekule propone que el carbono se podría unir consigo mismo. En una publicación de 1890, cuenta cómo llegó a esta idea, cuando dormía en un coche en Londres, viajando de casa de un amigo a la suya en una noche de verano.
Tanto la tetravalencia del carbono, como la unión entre átomos de carbono para formar cadenas también fueron consideradas y publicadas por Couper en 1858, como lo muestran sus fórmulas estructurales ya de avanzada (de mayor desarrollo mental).
De lo que si no hay duda es de que la estructura del benceno, líquido descubierto por Faraday en 1825, fue propuesta por Kekule. Los experimentos y conocimientos de la época no permitieron una solución fácil para la estructura de la molécula, pues no era sencillo conciliar su análisis elemental, que mostraba una relación C:H, 1:1 y su peso molecular de 78, calculado como era costumbre, a partir de las medidas de la densidad del vapor, que indicaban una fórmula C6H6, con la tetravalencia del C. Ninguna estructura en cadena funcionaba, su preocupación al respecto debía ser grande, pues de nuevo se conoce una anécdota que indicaba el camino a la solución. En este caso se trata de un sueño con una danza de serpientes en la que de pronto algunas de ellas parecían que se mordían la cola; el hecho es que Kekule propuso la estructura de anillo de 6 carbonos para el benceno pero ésta no fue fácilmente aceptada en su momento hasta no hacerle un par de refinamientos, para explicar la tetravalencia del carbono y el porqué no presentaba isómeros, Figura 1.
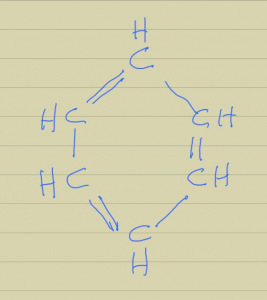
Figura 1. Fórmula estructural del benceno.
A comienzos del siglo XIX Biot, físico y médico francés, había encontrado que ciertos cristales y también sus soluciones desviaban la luz polarizada, recientemente descubierta; este hecho se atribuía a una estructura especial de las sustancias.
L. Pasteur, a partir de 1848, mediante un trabajo meticuloso, logró preparar tartrato doble de sodio y amonio y separar dos tipos de cristales cuya única diferencia era que las caras de los unos parecían orientadas en un sentido opuesto a las de los otros y que no eran idénticos o reemplazables, sino que los unos eran la imagen especular de los otros; él encontró que los unos desviaban la luz polarizada en un sentido mientras los otros lo hacían en el sentido opuesto; encontró que sus soluciones presentaban el mismo comportamiento y además que cuando se hacía una solución de concentraciones iguales de cada tipo de cristales, ésta no desviaba la luz polarizada.
En este momento estaba claro que aunque parecían sustancias iguales, en realidad no lo eran y que la diferencia debería estar en una estructura interna, pero no se tenía idea de cómo podría ser. Fue J. H. Van’t Hoff en 1874 quien sorprendió al mundo químico con una explicación precisa y sencilla. Le Bel hizo lo propio independientemente, meses después, pero nos referiremos al trabajo de Van’t Hoff, por lo “elegante”.
La propuesta de Van’t Hoff se puede resumir en: Para comprender el fenómeno de la isomería óptica, término propuesto por Pasteur, hay que aceptar que las moléculas tienen estructura espacial y no únicamente planar, entonces la tetraatomicidad (Valencia) del carbono está dirigida a los vértices de un tetraedro y no de un cuadrado[2].
Cuando los cuatro sustituyentes, grupos o átomos unidos al átomo de carbono, son todos diferentes entre sí, esta estructura molecular tetraédrica no presenta un plano de simetría y por lo tanto se presenta isomería óptica, se dice que la molécula es disimétrica o que el átomo de carbono es asimétrico. La estructura molecular tetraédrica se presenta en una de las dos formas o isómeros ópticos no superponibles, es decir, que la una no remplaza a la otra sino que la una es la imagen especular de la otra y por lo tanto cada uno de estos dos isómeros físicos (así se llamaron en aquel entonces), podría desviar la luz polarizada en sentido contrario a como lo haría el otro.
Con este trabajo de Van’t Hoff quedaron firmes las bases de la estructura molecular orgánica.
BIBLIOGRAFÍA
[1] The Evolution of the Atomic Theory, D. P. Mellor, Elsevier Publishing Company, 1971.
[2] Classics in the Theory of Chemical Combination, Theodor Benfey, Dover Publications Inc., New York, 1963.
[3] A Source Book in Chemistry, 1400-1900, H. M. Leicester and H. S. Klickstein, First Edition, McGraw-Hill Book Company Inc., 1952.
[5] A Short History of Chemistry, J. R. Partington, Macmillan and Co. Limited, London, 1939.
[6] Enciclopedia Biográfica de Ciencia y Tecnología, Isaac Asimov, Emece Editores, Buenos Aires, 1973.




