Los pilares de la estructura molecular II

Mi encuentro con la Química
25 octubre, 2018
Los pilares de la estructura molecular I
21 noviembre, 2018LOS PILARES DE LA ESTRUCTURA MOLECULAR
II – QUÍMICA DE COORDINACIÓN (1850-1914)
Arnulfo Poveda P., Universidad Nacional de Colombia- Bogotá
Ya en el siglo XVIII se había descubierto una serie de compuestos químicos, que inicialmente se nombraron por las regiones donde se encontraban y después según sus descubridores o fabricantes. Estos compuestos presentaban como característica unos colores deslumbrantes, los cuales sirvieron para clasificarlos.
Algunos de estos primeros compuestos, hoy todavía famosos, son el PtCL2.2NH3, o sal de Magnus, el KNO2.Co(NO2)2.2NH3 o sal de Erdman y el azul de Prusia o Berliner Blau, Fe(CN)2.4KCN, producido por Diesbach en Berlín a comienzos de los 1700 y que como otros complejos coloreados, fue utilizado por los pintores.
Los químicos comenzaron a interesarse por su composición y por su relación con otros compuestos. Se encontró, como puede notarse arriba, que estos compuestos parecían formados por otros compuestos más sencillos. Se les denominó moleculáres para diferenciarlos de los compuestos sencillos llamados atómicos. Más adelante se les dio el nombre por el que se les conoce todavía, el de “COMPLEJOS”, para diferenciarlos de los compuestos simples. A decir verdad era un nombre apropiado para la época, pues era difícil encontrar una explicación satisfactoria para su composición; además el número de compuestos aumentaba a medida que se estudiaban y ya era difícil nombrarlos y clasificarlos adecuadamente.
El desarrollo de los experimentos apropiados y el de los modelos para explicar su estructura sólo fue posible después de la aparición de teorías y modelos válidos para compuestos más sencillos. Los pasos fundamentales en este sentido fueron la definición de lo que se consideraba un compuesto verdadero, establecida por la ley de proporciones definidas “una sustancia química verdadera es aquella que tiene una composición constante” (J. L. Proust, 1799). Esta definición fue trascendental para separar una sustancia de otra, especialmente en el caso de los complejos, en donde se presentan muchas series similares. Posteriormente se propuso el concepto de isomería (J. J. Berzelius, 1832), que completaba la definición anterior, pero que planteaba la inquietud de cómo están unidos los átomos entre sí. En este sentido, es definitiva la teoría de los tipos. (Ch. Gerhardt, 1853), desarrollada para el amoniaco por Ch. A. Wurtz en 1849 y ampliada por A. W. Von Hoffmann, como teoría del amonio. Esta teoría intentó dar una primera explicación de cómo estaban los átomos en los abundantes complejos que contenían amoniaco.
La teoría de la fuerza de combinación o atomicidad (valencia), propuesta por E. Frankland en 1852, es también crucial pues permitió llegar a la conclusión de que cada átomo sólo se puede unir a un número fijo de otros elementos. Así, se infería que la atomicidad del Zn siempre era 2 y la del N y P, 3 o 5. La propuesta de F. A. Kekule en 1858, de que los átomos de carbono se podían unir entre si, para formar cadena, condujo a la formulación de un segundo modelo para explicar la estructura de los complejos. Este modelo, llamado de las cadenas, fue desarrollado en 1869 y sustentado con éxito durante varias décadas por los escandinavos Blomstrand, profesor de química de la Universidad de Lund (Suecia) y su alumno M. Jörgensen, más tarde profesor de la Universidad de Copenhague y uno de los experimentadores más sobresalientes en la química de los complejos. Para explicar la estructura del CoCl3.6NH3, este modelo proponía que las moléculas de NH3 podrían también formar cadenas en la forma mostrada en la Figura 1. Sin embargo fue el mismo Jörgensen quien logró sintetizar el complejo IrCl3.3NH3, compuesto clave que demostró que la teoría en este caso fallaba y por lo tanto no era correcta.
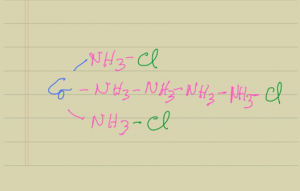
Figura 1. Modelo estructural de las cadenas para el compuesto CoCl3.6NH3.
Alfred Werner, profesor de química en Zürich, Suiza, es el químico que descorre el telón del misterio de los complejos; su genialidad fue el considerar que había más de un tipo de valencia o atomicidad o clases de unión de unos átomos con otros, más aún, no sólo que había dos tipos de valencia, sino que un mismo átomo podía exhibir estos dos tipos de valencia.
La primera parte de su teoría de la coordinación, publicada en 1893, se puede resumir en los siguientes tres postulados:
- Los elementos químicos presentan dos tipos de valencia, la primaria o unión ionizable, hoy número de oxidación y la valencia secundaria o unión no ionizable, hoy número de coordinación.
- Los elementos tienden a satisfacer tanto su valencia primaria como su valencia secundaria.
- La valencia secundaria o número de coordinación, está dirigida hacia posiciones definidas en el espacio.
Estos tres postulados daban una explicación satisfactoria a las preguntas que venían haciendo los químicos respecto a los complejos.
Tomando la bien conocida serie de la “amminas” CoCl3.6NH3, CoCl3.5NH3, CoCl3. 4NH3, CoCl3.3NH3 y con base en estos postulados tenemos: La valencia primaria o estado de oxidación del Co en todos estos casos es 3+ y su valencia secundaria o número de coordinación es 6. El estado de oxidación 3+ del Co está compensado, como se ve claramente en todos los casos, por tres grupos de cloro, que en el primer caso son todos iónicos y no hacen parte del catión complejo. En el CoCl3.6NH3 el número de coordinación está satisfecho por los 6 amoníacos, [Co(NH3)6]Cl3; en el segundo, por 5 NH3 y 1 Cl que representamos dentro de un corchete, así [CoCl(NH3)5]Cl2; en el tercer caso por 4 NH3 y 2 Cl, [CoCl2(NH3)4]Cl y en el último, por 3 NH3 y 3 Cl formando el complejo molecular no iónico [CoCl3(NH3)3]. Gráficamente pueden representarse como se muestra en la Figura 2.
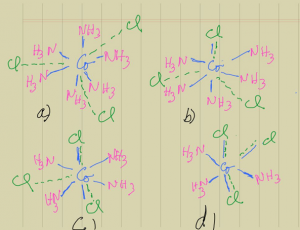
Figura 2. Fórmulas Estructurales de Werner para:
- a) [Co(NH3)6]Cl3 b) [CoCl(NH3)5]Cl2
- c) [CoCl2(NH3)4]Cl d) [CoCl3(NH3)3]
Estos postulados concordaban con los hechos experimentales de conductividades molares debidas a la disociación en más o menos iones y con la determinación cuantitativa de los iones Cl– en las soluciones de estos compuestos.
El número de coordinación puede considerarse como el número de puestos alrededor del ión metálico, en este caso el Co 3+, que deben estar siempre ocupados, así cuando sale una molécula de amoníaco de uno de estos puestos inmediatos el mismo es ocupado por algún elemento del medio cercano, bien sea un ion como el Cl–, o moléculas del solvente. En algunos textos se habla de la saturación de la esfera de coordinación. En las representaciones anteriores, dentro del corchete cuadrado [ ] se indica la unidad de coordinación, constituida por el ion central, Co 3+ y en todos los casos, por seis grupos que satisfacen el número de coordinación.
El tercer postulado es la base de la estereoquímica o estructura espacial, planteada inicialmente por J. H. Van’t Hoff (1874) para el caso de los compuestos orgánicos. Al respecto, Werner dedujo que las entidades con número de coordinación 6 deberían ser octaédricas. Para llegar a esta conclusión siguió un método similar al empleado por W. Kürner (1874), quien propuso la estructura del benceno con base en los isómeros de sus derivados teóricamente posibles. Werner supuso que los complejos con número de coordinación 6 deberían ser simétricos y entonces podrían, o bien tener una estructura hexagonal planar o de prisma trigonal u octaédrica. Analizando el número de isómeros teóricos posibles y comparándolos con el número de isómeros sintetizados para composiciones del tipo [MA2B4] y [MA3B3], llegó a la conclusión de que los complejos con número de coordinación 6 deberían ser octaédricos. Esta propuesta fue contundentemente ratificada por el mismo Werner a raíz de los isómeros ópticos encontrados para varios complejos, incluidos algunos con ligantes bidentados[1].
Cuando Werner afirmaba que la presencia de isomería óptica para complejos del tipo [M(AA)3] era evidencia de la estructura octaédrica debida a la disimetría de la molécula, algunos químicos orgánicos le rebatían su hipótesis aduciendo que la misma se debía únicamente a la presencia de átomos de carbono en la estructura y no a otra propiedad diferente.
Esta controversia llevó a Werner y su grupo en 1914 a sintetizar el más extraordinario complejo de la época, uno que no contenía carbono en su estructura este presentó, como es obvio, isomería óptica, consolidando la teoría de la coordinación, pero además mostró que esta isomería es una función de la simetría de las moléculas en general y no se debe sólo a la presencia de un átomo, Figura 3. Esta conclusión conlleva a ver la química como una sola, son normas generales y a derrumbar murallas impuestas artificialmente entre la química orgánica y la inorgánica.
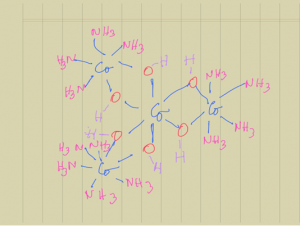
Figura 3. Fórmula Estructural de {Co(OH)6 [Co(NH3)4]3}
Cuando Werner pudo explicar satisfactoriamente las propiedades de los complejos, con base en sus modelos estructurales, no quedó la menor duda de que se había elucidado el misterio de los complejos y desde ese entonces, dejaron de ser complejos y se les conoce como Compuestos de Coordinación.
De esta manera se sentaron sólidamente las bases de la estructura molecular, la cual es a nuestro parecer la herramienta más poderosa para comprender la Química.
BIBLIOGRAFÍA
[1] The Evolution of the Atomic Theory, D. P. Mellor, Elsevier Publishing Company, 1971.
[2] Classics in the Theory of Chemical Combination, Theodor Benfrey, Dover Publications, Inc., New York, 1963.
[3] A Source Book in Chemistry, 1400-1900, H. M. Leicester and H. S. Klikstein, First Edition, McGraw-Hill Book Company Inc., 1952.
[4] Classics in Coordination Chemistry, George B. Kauffman, Dover Publications inc., New York, 1968.
[5] A Short History of Chemistry, J. R. Partington, Macmillan and Co. Limited, London, 1939.
[6] Enciclopedia Biográfica de Ciencia y Tecnología, Isaac Asimov, Emecé Editores, Buenos Aires, 1973.
[7] An Introduction to the Chemistry of Complex Compounds, A. A. Gringberg, Pergamon Press, 1962.
[1] Un ligante bidentado es una molécula que se puede unir simultáneamente al ion metálico por medio de dos átomos diferentes.




